La generación y aprobación de documentos son un enfoque clave para cada negocio. Ya sea manejando grandes volúmenes de documentos o un contrato particular, debes mantenerte en la cima de tu eficiencia. Conseguir una plataforma en línea ideal que aborde tus dificultades más típicas de creación y aprobación de registros podría resultar en mucho trabajo. Numerosas aplicaciones en línea ofrecen solo una lista mínima de funciones de edición y firma, algunas de las cuales podrían ser valiosas para gestionar el formato de archivo UOML. Una solución que maneje cualquier formato de archivo y tarea sería una opción sobresaliente al seleccionar la aplicación.
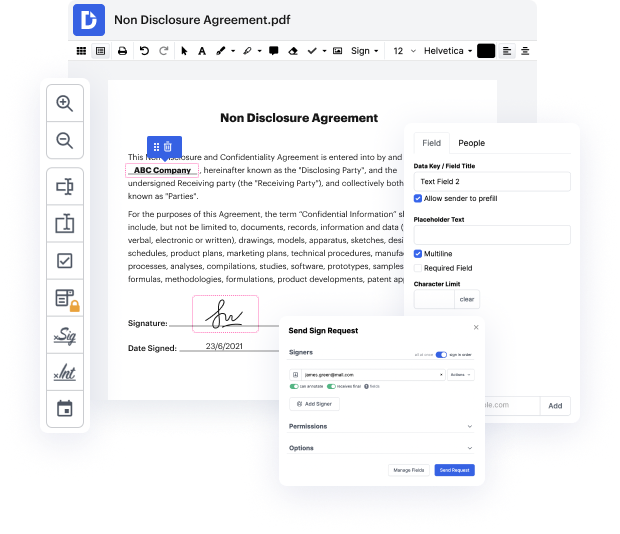
Lleva la gestión y creación de archivos a un nivel diferente de simplicidad y excelencia sin elegir una interfaz de programa incómoda o un plan de suscripción costoso. DocHub te proporciona herramientas y características para manejar eficazmente todos los tipos de archivos, incluyendo UOML, y realizar tareas de cualquier dificultad. Edita, organiza y crea formularios rellenables reutilizables sin esfuerzo. Obtén total libertad y flexibilidad para corregir la identificación en UOML en cualquier momento y almacena de forma segura todos tus archivos completos dentro de tu cuenta o en una de las varias aplicaciones de almacenamiento en la nube integradas posibles.
DocHub proporciona edición sin pérdida, recolección de firmas y gestión de UOML a niveles profesionales. No necesitas pasar por guías tediosas y gastar horas y horas averiguando la aplicación. Haz que la edición segura de archivos de primer nivel sea un proceso estándar para tus flujos de trabajo diarios.
en 2013, la Administración de Alimentos y Medicamentos de EE. UU. fue mandatada para implementar regulaciones que exigen que los dispositivos médicos distribuidos en los Estados Unidos lleven un identificador único de dispositivo conocido como UDI. un UDI consiste en dos partes: un identificador de dispositivo y un identificador de producción. la parte DI de un UDI se utiliza para identificar el tipo de dispositivo. los identificadores de dispositivo son proporcionados por una agencia emisora acreditada por la FDA. la parte PAI de un UDI identifica la información de producción de un dispositivo, como su número de lote o su fecha de caducidad. si una empresa fabrica múltiples lotes del mismo dispositivo, el DI para cada lote será el mismo, pero el PAI será diferente. los UDI deben incluirse en el etiquetado de un dispositivo y deben mostrarse en un formato legible por humanos y legible por máquinas. si el dispositivo está destinado a ser utilizado más de una vez y se pretende que sea reprocesado antes de cada uso, el UDI también debe colocarse en el propio dispositivo. los etiquetadores de dispositivos son responsables de cumplir con los nuevos requisitos de UDI de la FDA. la FDA define un de